Les atomes puis les molécules
Cette approche classique – qui était sûrement celle de mes enseignants parce que c’est celle que j’ai tout d’abord adoptée dans mes premières années d’enseignement – suit la logique de la construction de la matière : je pars du plus petit (atome, proton, neutron, électron), j’assemble mes pièces et j’obtiens une matière ou une autre.
Cette façon de faire est très abstraite : l’élève doit accepter a priori cette centaine de pièces de Lego avec lesquelles je suis capable de réaliser tout ce que je veux, du château de princesse au vaisseau spatial en passant par un jardin potager.
Comme j’ai l’impression qu’un cours de chimie se passe souvent de cette manière, c’est-à-dire en commençant par dire que tout est fait d’atomes, je ne m’arrêterai pas plus que ça sur cette approche-là. Mais ça ne veut pas dire que j’en pense du mal !
Les molécules puis les atomes
Commençons donc par les molécules…
En partant « à l’envers », bien que l’envers et l’endroit soient tout à fait relatifs, on part du concret : j’ai de la matière devant moi. Cette matière réagit aux contraintes physiques que je lui impose (pression, température, …). Sans expliquer clairement ce que sont les molécules, on peut modéliser très rapidement de nombreux phénomènes. Pour cela, les élèves doivent accepter un modèle moléculaire réduit au strict minimum :
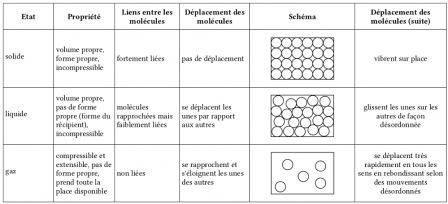
- la masse, le volume et la forme d’une molécule ne change pas
- il existe plusieurs sortes de molécules composant les diverses substances
- une substance peut être pure ou un mélange
À partir de là, on complète le modèle :
- entre les molécules, il y a du vide (compressibilité d’un gaz)
- gaz : molécules dispersées, pas liées, prenant toute la place à disposition
- liquide : molécules rapprochées, désordonnées et peu liées
- solide : molécules rapprochées, ordonnées et liées
Voici un tableau que j’utilise (cf. conclusion de l’article) :
En choisissant des phénomènes courants, bien connus des élèves, on affine un peu notre modèle, et surtout, on l’applique afin qu’il devienne familier aux élèves :
- diffusion d’un gaz : les molécules bougent très rapidement et s’entrechoquent
- odeur qui se répand dans toute la pièce (encens, parfum, …)
- pression d’un gaz = choc des molécules sur une surface
- ballon qui se gonfle tout seul dans une cloche à vide
- température : plus les molécules s’agitent, plus la température est élevée
- gaz : chauffer une éprouvette bouchée, le bouchon saute
- liquide : une goutte d’encre se mélange plus rapidement dans de l’eau chaude
- solide : faire chauffer les dents de la fourchette sur une flamme et sentir, au bout d’un moment, ses doigts chauffer (utiliser un brûleur, pas une bougie)
- dilatation d’un solide : la température augmente l’agitation des molécules, qui s’éloignent un peu les unes des autres
- expérience classique de la boule métallique qui ne passe plus dans l’anneau une fois chauffée
- connaissances des élèves (joints de dilatation par exemple)
- dissolution : la température augmente l’agitation des molécules du liquide, qui frappent plus fortement et fréquemment le solide en dissolution
- laisser dissoudre du sucre candi dans de l’eau froide et dans de l’eau chaude, sans remuer
On passe ensuite aux changements d’état : la température augmente l’agitation, on passe donc de molécules rapprochées et liées (solide) à des molécules désordonnées, mais toujours rapprochées (liquide), puis l’agitation augmente encore et les molécules cassent leurs liens et s’éloignent (gaz).
On remarque que tout le cours est tourné vers l’explication de phénomènes concrets. Certes ce n’est pas vraiment de la chimie, puisque seuls les liaisons « physiques » entre les molécules d’une même matière sont étudiées, mais pour les élèves, c’est déjà un premier pas vers l’infiniment petit.
… puis venons aux atomes
Notre modèle moléculaire est bien construit, bien joli, mais il n’explique évidemment pas tout. C’est là que je trouve cette approche meilleure que l’autre. Une fois le modèle intégré, et vu qu’on l’a sans arrêt utilisé, ça devrait être le cas, on sort de son sac magique une jolie réaction chimique (du gaz qui brûle, de carbonate dans de l’acide, …) et on observe qu’avec deux matières, on peut en fabriquer une troisième qui n’a absolument rien à voir.
J’aime bien mettre en réaction du CaCO3 (ou de la craie, tant qu’on en a encore en stock…) et de l’HCl, dans une fiole, récupérer le gaz et le déterminer : je mélange un solide et un liquide et j’obtiens du CO2 (un gaz) ! Alors là, mon modèle moléculaire est insuffisant pour expliquer ce qui s’est passé. L’élève n’a pas le choix, il doit accepter l’existence de particules plus petites que les molécules.
Bien sûr, durant les chapitres précédents, il m’est arrivé de parler d’H2O, d’O2, de CO2, tout n’est pas nouveau, mais souvent les élèves font à ce moment le lien entre la réaction chimique et les atomes qui composent la molécule. En puisque nous avons beaucoup travaillé le modèle moléculaire, il n’est pas difficile pour eux de comprendre la conservation de la matière d’un point de vue atomique.
Conclusion
Je ne livre pas ici tout mon cours « clé en main », surtout que je me suis très très largement inspiré de séquences genevoises gentiment mises à disposition par l’animation de sciences du canton, et de la progression des apprentissages proposée par cette même animation. Par contre, cet article était pour moi l’occasion de mener une réflexion sur la façon d’aborder la chimie, sachant que c’est la seule fois où les élèves étudient cette matière durant la scolarité obligatoire (ça ne revient pas en 3CO, dommage).
Je mets par contre à disposition un tableau que j’utilise pour caractériser les états de la matière (cf. illustration ci-dessus). Le document est sur deux pages, la première étant un tableau dont les lignes sont toutes mélangées (les élèves découpent et remettent dans l’ordre). La deuxième page contient le tableau correct. Ce tableau, je ne le distribue pas forcément en une fois (la dernière colonne peut être distribuée lorsqu’on voit la température).

De l’atome aux molécules, ou inversement ?
Votre article est intéressant et présente de nombreux arguments en faveur d’une approche d’abord moléculaire. Je suis professeur de chimie dans le 1er cycle de l’enseignement supérieur français, section de technicien supérieur principalement. Au collège cette démarche a été adoptée : commencer par présenter les molécules avant de s’intéresser aux atomes, depuis quelques années. J’ai moins même eu l’occasion de la mettre en œuvre pour des classes de seconde de lycée où à première vue elle est très bien passée (je leur ai mis entre les mains le modèle moléculaire de l’aspirine et à partir de là, ils ont retrouvé la notion d’atome, de valence, de liaison simple ou double etc…).
Mais le gros point noir, c’est que depuis que cette démarche est adoptée, je ne cesse de voir dans les copies d’examen une confusion quasi systématique entre les mots atome et molécule, il en est de même pour mes collègues de biochimie. Exemple : le fluor 18 est une molécule radioactive ! L’atome de glucose doit être injecté au patient etc… Ce qui n’était pas le cas lorsque la chimie était enseignée dès le début de façon certes moins intuitive mais plus « classique » en commençant par l’atome !